Die Zitronenbatterie ist ein einfacher Versuch zur Stromerzeugung auf chemischem Wege. Es wird nicht viel dafür benötigt. Lesen Sie in diesem Beitrag, ob und wie es funktioniert und was Sie beachten sollten.

Strom aus der Zitrone und was Sie dafür benötigen
Alternative Energien mal anders, und zwar mit einer Zitronenbatterie. Die Zitronenbatterie liefert im wahrsten Sinne des Wortes Saft, nämlich Zitronensaft. Allerdings ist sie auch in der Lage, Saft in Form elektrischer Energie zu liefern, wenn man ein kleines Experiment wie das hier vorgestellte durchführt. Es braucht gar nicht viel, um eine einfache Batterie mithilfe einer Zitrone herzustellen.
Außer einer Zitrone bzw. den zwei Hälften werden noch Stücke aus unterschiedlichen Metallen, ein paar Verbindungsleitungen sowie ein Anzeigeinstrument oder eine einfache Digitaluhr gebraucht, um das Experiment durchzuführen. Ich habe zwei Streifen aus Zinkblech sowie einen Kupferstreifen sowie eine Kupfermünze als verschiedene Metalle verwendet, die in die Zitrone hineingesteckt werden. Wahrscheinlich lassen sich auch andere Metallarten verwenden. Es kommt auf einen Versuch an. Das Bild oben zeigt einen kompletten Versuchsaufbau, bei dem zwei Zitronenbatterien in Reihe geschaltet wurden. Mit einer Zitronenbatterie alleine wollte die kleine LCD-Uhr noch nicht laufen. Durch die Reihenschaltung verdoppelt sich die Betriebsspannung, und die Uhr funktioniert einwandfrei.
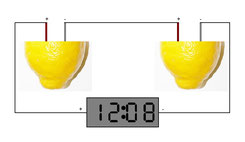
Das „Schaltbild“ bzw. die nebenstehende Skizze zeigt den Versuchsaufbau noch einmal schematisch. Links in den Zitronen befinden sich die Kupferstreifen, welche die Pluspole der Batterien darstellen. Rechts zu sehen sind die Zinkstreifen als Minuspole der Batterien. Der Pluspol der einen und der Minuspol der anderen Zitronenbatterie wurden miteinander verbunden, während die zwei übrig gebliebenen Anschlüsse als Stromanschlüsse für die Uhr fungieren. Beide Batterien zusammen hatten eine Spannung von ca. 1,8 Volt, also etwa 0,9 Volt pro Batterie.
Wie die elektrische Spannung in der Zitronenbatterie entsteht
Möglich macht dies das saure Fruchtfleisch aus der Zitrone, das im Zusammenspiel mit den beiden Metallarten eine chemische Reaktion hervorruft. Die beiden Metallstreifen in der Zitrone werden auch als Elektroden bezeichnet. Der Zitronensaft enthält einen relativ hohen Anteil an Säure und ist daher elektrisch leitend. Er wird als Elektrolyt bezeichnet. In einer chemischen Reaktion werden Elektronen und Metallionen in der Säure freigesetzt und vom Zink an das Kupfer abgegeben. Genau dieser Elektronenfluss ist der elektrische Strom. Das Zink wird als unedleres Metall von beiden bezeichnet, da es schneller Elektronen abgibt als das edlere Kupfer. Dies ist das der Grund dafür, weshalb für diesen Versuch zwei verschiedene Metallarten verwendet werden sollten. Übrigens funktioniert der Versuch auch mit anderen Arten von Früchten wie beispielsweise Orangen, rohen Kartoffeln oder Äpfeln. Allerdings sollten die benutzten Früchte nach dem Experiment nicht mehr verzehrt werden, da eine chemische Reaktion im Fruchtsaft stattgefunden hat und die Frucht dadurch ungenießbar wird.